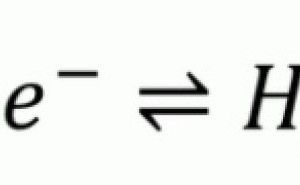1. 標準水素電極 ~ 標準的な基準電極
イオン化傾向は各金属の電位(正確には電極電位という)の相対値ですが、電気化学的には各金属は固有の電位の値を持っています。
ダニエル電池における亜鉛と銅の反応はそれぞれの電位をもとに電位差が生まれ、反応が起こります。亜鉛と銅の電位差を測定することはできますが、亜鉛と銅のそれぞれの電位を測定することはできません。そこで基準となる電位を決めて、それに対する亜鉛と銅のそれぞれの電位を測定を行っています。
この基準となる電位を標準水素電極といいます。これは温度に関わらず0Vと決められています。酸性溶液中における白金電極上での水素の反応は式(1)のようになります。この時、水素イオンのモル濃度1mol/L(正確には活量1)、水素ガスが1気圧となる時は電位E=0Vという電極です。
このような標準水素電極と亜鉛を組み合わせれば、標準水素電極0Vに対する亜鉛の電位を求めることができます。この亜鉛の反応はアノード反応だけを取り出しているので半電池と呼びます。標準水素電極が0Vなので、得られた電位差が亜鉛の電位となります。同様に標準水素電極と銅を組み合わせれば銅の電位を測定することができます。
2. 参照電極
電位の基準は標準水素電極ですが、この電極は扱いが難しいのです。そのため、標準水素電極に対して一定の電位を示す電極を使用します。この電極を参照電極や照合電極といいます。
参照電極に求められることとして、電極反応が可逆で電極電位がネルンストの式[1]にしたがうこと、電位を測定する時に電流によって電位が変化しないこと、競争反応がないこと、どの環境でも電位が一定であることなどが望まれます。表1に代表的な参照電極を示します。
表1.参照電極例(25℃)
飽和カロメル電極は甘汞(かんこう)電極ともいいます。
電解液として飽和塩化カリウム水溶液を用いた飽和カロメル電極が使用されます。しかし飽和カロメル電極にはHgが使用されるため、使用することが減少しています。銀・塩化銀電極は銀の表面を塩化銀で覆い、それを塩化物水溶液に浸したものです。塩化物水溶液には飽和塩化カリウム水溶液が使用されます。近年広く使用される参照電極です。
電位測定の時には参照電極と測定する半電池の環境が混ざらないように塩橋(えんきょう)とよばれるもので接続します。イオンは塩橋を通過できますが、原子や分子は塩橋を通過できません。
次回に続きます。
【用語解説】
[1]ネルンストの...