◆ イオン
多くの金属原子は電子の軌道を考えた場合、最外殻に数個の電子があります(価電子)。
金属原子の価電子の数は1から3個程度のことが多く、電子軌道は最外殻の電子が8個の状態が最も安定します。この状態がオクテット則[1]です。ネオンやアルゴンなど、希ガスの元素はこのオクテット構造のため非常に安定です。
例えば、ナトリウム原子は最外殻のM殻に電子が1個あります。最外殻に1個の電子がある状態は不安定で、もしM殻の1個の電子を放出すれば、L殻の8個の電子が最外殻となり、電子軌道的に安定します。
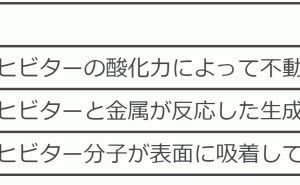
この最外殻の電子が放出して最外殻をオクテットにした状態(原子によっては電子を取込む時もあり得る)をイオンと呼びます。これを図1に示します。ナトリウムの場合、電子を1個放出します。この時は元素記号に「+」だけを表記して1は省略します。この数字を酸化数や価数などと呼びます。
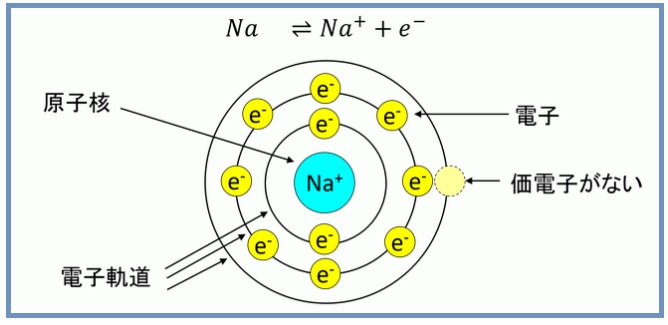
図1. ナトリウムイオン
原子の中には塩素や酸素のように価電子の数が多く、電子を取り入れた方がよい原子もあります。塩素や酸素は電子を取り入れてマイナスイオンとなります。塩素イオンを図2に示します。プラスイオンと同様に元素の上の数字は取り入れた電子の数を表します。
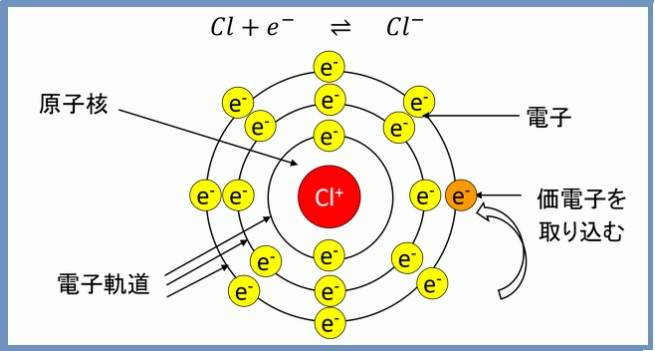
図2. 塩素イオン
次回に続きます。
【用語解説】
[1]オクテット則:オクテット則(オクテットそく、英語: Octet rule)は原子の最...








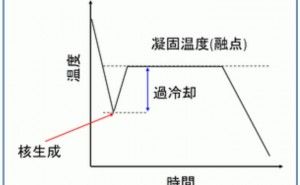
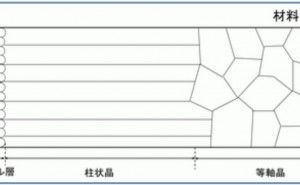
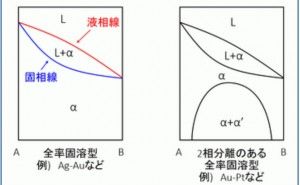
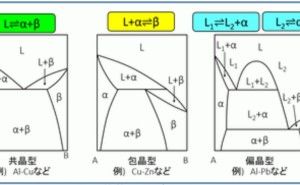






























































![金属材料基礎講座[機能材料・強度設計コース] 金属材料基礎講座[機能材料・強度設計コース]](https://assets.monodukuri.com/product/photo/5a73d3e9-bfc0-4c45-a6ba-2fc4e284732d.jpeg?d=0x0)






